Ibridazione del carbonio in cosa consiste, tipi e loro caratteristiche
il ibridazione del carbonio comporta la combinazione di due orbitali atomici puri per formare un nuovo orbitale molecolare "ibrido" con le sue caratteristiche. La nozione di orbitale atomico fornisce una spiegazione migliore rispetto al precedente concetto di orbita, per stabilire un'approssimazione di dove c'è una maggiore probabilità di trovare un elettrone all'interno di un atomo.
In altre parole, un orbitale atomico è la rappresentazione della meccanica quantistica per dare un'idea della posizione di un elettrone o coppia di elettroni in una certa area all'interno dell'atomo, dove ciascun orbitale è definito in base ai valori dei suoi numeri quantistica.

I numeri quantici descrivono lo stato di un sistema (come quello dell'elettrone all'interno dell'atomo) in un determinato momento, per mezzo dell'energia che appartiene all'elettrone (n), il momento angolare che descrive nel suo movimento (l), il momento magnetico relativo (m) e la rotazione dell'elettrone mentre si muove all'interno dell'atomo (i).
Questi parametri sono unici per ciascun elettrone in un orbitale, quindi due elettroni non possono avere esattamente gli stessi valori dei quattro numeri quantici e ciascun orbitale può essere occupato al massimo da due elettroni.
indice
- 1 Cos'è l'ibridazione del carbonio?
- 2 tipi principali
- 2.1 Ibridazione Sp3
- 2.2 Ibridazione sp2
- 2.3 Ibridazione sp
- 3 riferimenti
Qual è l'ibridazione del carbonio?
Per descrivere l'ibridazione del carbonio si deve tenere conto del fatto che le caratteristiche di ciascun orbitale (la sua forma, energia, dimensione, ecc.) Dipendono dalla configurazione elettronica di ciascun atomo.
Cioè, le caratteristiche di ciascun orbitale dipendono dalla disposizione degli elettroni in ogni "strato" o livello: dal più vicino al nucleo al più esterno, noto anche come guscio di valenza.
Gli elettroni del livello più esterno sono gli unici disponibili per formare un legame. Pertanto, quando si crea un legame chimico tra due atomi, viene generata la sovrapposizione o sovrapposizione di due orbitali (uno di ciascun atomo) e questo è strettamente correlato alla geometria delle molecole.
Come detto sopra, ciascun orbitale può essere riempito con un massimo di due elettroni ma deve essere seguito il principio Aufbau, con il quale gli orbitali vengono riempiti in base al loro livello di energia (dal più basso al più alto), come mostra di seguito:

In questo modo, il livello 1 viene riempito per primos, quindi 2s, seguito da 2p e così via, a seconda di quanti elettroni ha l'atomo o lo ione.
Pertanto, l'ibridizzazione è un fenomeno corrispondente alle molecole, poiché ogni atomo può fornire solo orbitali atomici puri (s, p, d, F) e, a causa della combinazione di due o più orbitali atomici, viene formato lo stesso numero di orbitali ibridi che consentono i collegamenti tra gli elementi.
Tipi principali
Gli orbitali atomici hanno diverse forme e orientamenti spaziali, aumentando in complessità, come mostrato di seguito:

Si osserva che esiste un solo tipo di orbitale s (forma sferica), tre tipi di orbitale p (forma lobulare, dove ogni lobo è orientato su un asse spaziale), cinque tipi di orbitali d e sette tipi di orbitali F, dove ogni tipo di orbitale ha esattamente la stessa energia del suo tipo.
L'atomo di carbonio nel suo stato fondamentale ha sei elettroni, la cui configurazione è 1s22s22p2. Cioè, dovrebbero occupare il livello 1s (due elettroni), il 2s (due elettroni) e parzialmente 2p (i restanti due elettroni) secondo il principio di Aufbau.
Ciò significa che l'atomo di carbonio ha solo due elettroni spaiati nell'orbitale 2p, ma non è possibile spiegare la formazione o la geometria della molecola di metano (CH4) o altri più complessi.
Quindi per formare questi legami hai bisogno dell'ibridazione degli orbitali s e p (nel caso del carbonio), per generare nuovi orbitali ibridi che spieghino anche i legami doppio e triplo, in cui gli elettroni acquisiscono la configurazione più stabile per la formazione di molecole.
Ibridazione sp3
Ibridazione sp3 consiste nella formazione di quattro orbitali "ibridi" dagli orbitali 2s, 2px2pe e 2pz pura.
Quindi, abbiamo il riarrangiamento degli elettroni nel livello 2, dove ci sono quattro elettroni disponibili per la formazione di quattro legami e sono ordinati in parallelo per avere meno energia (maggiore stabilità).
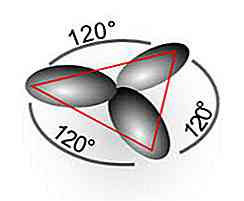
Un esempio è la molecola di etilene (C2H4), i cui collegamenti formano angoli di 120 ° tra gli atomi e forniscono una geometria trigonale piatta.
In questo caso, vengono creati legami semplici C-H e C-C (a causa di orbitali) sp2) e un doppio legame C-C (a causa dell'orbitale) p), per formare la molecola più stabile.

Ibridazione sp2
Attraverso l'ibridazione sp2 tre orbitali "ibridi" sono generati dal puro orbitale 2s e tre orbitali puri 2p. Inoltre, si ottiene un porbitale puro che partecipa alla formazione di un doppio legame (detto pi: "π").
Un esempio è la molecola di etilene (C2H4), i cui collegamenti formano angoli di 120 ° tra gli atomi e forniscono una geometria trigonale piatta. In questo caso, vengono creati legami semplici C-H e C-C (a causa degli orbitali sp).2) e un doppio legame C-C (dovuto al p orbitale), per formare la molecola più stabile.
 Ibridazione sp
Ibridazione sp
Con l'ibridazione sp sono stabiliti due orbitali "ibridi" dal orbitale puro 2s e tre orbitali puri 2p. In questo modo si formano due orbitali p puri che partecipano alla formazione di un triplo legame.
Per questo tipo di ibridazione, la molecola di acetilene (C) è presentata come un esempio2H2), i cui collegamenti formano angoli di 180 ° tra gli atomi e forniscono una geometria lineare.
Per questa struttura, ci sono dei legami semplici C-H e C-C (dovuti agli orbitali dello sp) e un triplo legame C-C (cioè due legami pi grazie ai p orbitali), per ottenere la configurazione con meno repulsione elettronica.

riferimenti
- Ibridazione orbitale Estratto da en.wikipedia.org
- Fox, M. A. e Whitesell, J. K. (2004). Chimica organica Recuperato da books.google.co.ve
- Carey, F. A., e Sundberg, R. J. (2000). Chimica organica avanzata: parte A: struttura e meccanismi. Recuperato da books.google.co.ve
- Anslyn, E. V. e Dougherty, D. A. (2006). Chimica organica fisica moderna. Recuperato da books.google.co.ve
- Mathur, R. B; Singh, B. P. e Pande, S. (2016). Nanomateriali di carbonio: sintesi, struttura, proprietà e applicazioni. Recuperato da books.google.co.ve



 Ibridazione sp
Ibridazione sp