Struttura, proprietà e usi dell'idrossido di cromo
il idrossido di cromo è un prodotto composto inorganico della reazione di una base con un sale di cromo. La sua formula chimica varia a seconda dello stato di ossidazione del cromo (+2 o +3, per questo tipo di composto). Avendo quindi Cr (OH)2 per l'idrossido di cromo (II) e Cr (OH)3 per l'idrossido di cromo (III).
Per ragioni elettroniche, il Cr2+ è più instabile di Cr3+, quindi il Cr (OH)2 è un agente riducente (perde un elettrone per passare a +3). Quindi, sebbene entrambi gli idrossidi possano essere ottenuti come precipitati, Cr (OH)3 -anche chiamato idrossido cromico- è il composto predominante.

A differenza di quegli idrossidi ottenuti dalla semplice dissoluzione di ossidi metallici in acqua, Cr (OH)3 non è sintetizzato da questa via a causa della scarsa solubilità dell'ossido cromico (Cr2O3, immagine superiore). Tuttavia, Cr (OH)3 È considerato come il Cr2O3· XH2Oppure, usato come un pigmento verde smeraldo (verde Guinet).
Nella parte di laboratorio del cromo metallico, che viene sciolto in soluzione acida per la formazione del complesso [Cr (OH2)6]3+. Questo complesso acquoso reagisce poi con una base (NaOH o KOH) per formare il corrispondente idrossido cromico.
Se i passaggi precedenti sono eseguiti in condizioni che assicurano l'assenza di ossigeno, la reazione origina Cr (OH)2 (idrossido di cromo). Successivamente, è richiesta una separazione e una disidratazione del solido precipitato. Di conseguenza, "true" (OH) è "nato"3, una polvere verde con una struttura polimerica e incerta.
indice
- 1 struttura
- 1.1 L'ottaedro e la polimerizzazione
- 2 Proprietà fisiche e chimiche
- 2.1 Anfotericismo
- 3 Sintesi di idrossido di cromo in campo industriale
- 4 usi
- 5 riferimenti
struttura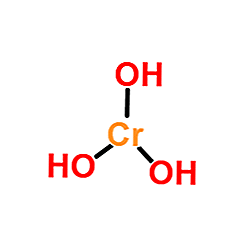
L'immagine superiore è la rappresentazione più semplice di Cr (OH)3 in fase gassosa e isolata. Allo stesso modo e assumendo il carattere puramente ionico delle loro interazioni, nei solidi Cr cation possono essere visualizzati3+ interagendo con una quantità triplicata di anioni OH-.
Tuttavia, la natura del legame Cr-OH è più covalente, a causa della chimica di coordinamento del Cr3+.
Ad esempio, il complesso [Cr (OH2)6]3+ indica che il centro metallico di cromo è coordinato con sei molecole d'acqua; Poiché questi sono neutri, il complesso mostra la carica positiva del catione originale, Cr3+.
L'ottaedro e la polimerizzazione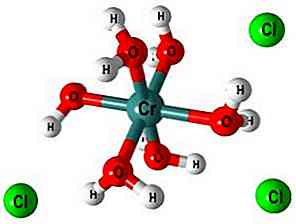
Nell'immagine in alto, la struttura del complesso [Cr (OH2)6]3+. Cl ioni- possono venire, per esempio, dall'acido cloridrico se è stato usato per la dissoluzione del sale o dell'ossido cromico.
Quando viene aggiunto NaOH (o KOH) al mezzo di reazione, lo ione OH- deprotonates una molecola di questo complesso, formando [Cr (OH2)5(OH)]2+ (Ora ci sono cinque molecole di acqua perché il sesto ha perso un protone).
Consecutivamente, questo nuovo complesso disidrata un altro complesso acquoso, creando dimeri legati da ponti di idrossido:
(H2O)5Cr-OH-Cr (OH2)5
Quando la basicità del mezzo aumenta (il pH sale) il complesso si forma [Cr (OH2)4(OH)2]+e anche aumentare la probabilità di nuovi ponti di idrossido per creare polimeri gelatinosi. In realtà, questa "gelatina grigio-verde" si rifiuta di correre in modo ordinato.
Infine, il Cr (OH2)3(OH)3 consiste in un ottaedro con il Cr3+ al centro e collegato a tre molecole d'acqua e tre OH- che neutralizza la sua carica positiva; questo senza considerare la polimerizzazione.
Quando il Cr (OH2)3(OH)3 si disidrata, l'acqua coordinata con il Cr viene eliminata3+e poiché questo catione è coordinato con sei specie (ligandi), sorgono strutture polimeriche in cui possono essere coinvolti legami Cr-Cr.
Inoltre, quando disidratato, la sua struttura può essere considerata di tipo Cr2O3· 3H2O; in altre parole, l'ossido cromico triidrato. Tuttavia, sono gli studi fisico-chimici del solido che possono far luce sulla vera struttura di Cr (OH)3 a questo punto.
Proprietà fisiche e chimiche
The Cr (OH)3 Ha l'aspetto di una polvere blu-verde, ma quando viene a contatto con l'acqua forma un precipitato gelatinoso grigio-verde.
È insolubile in acqua, ma solubile in acidi forti e basi. Inoltre, quando riscaldato, si decompone, producendo vapori di ossido di cromo.
Anfotero
Perché l'idrossido di cromo è solubile in soluzioni acide e basiche? Il motivo è dovuto alla sua natura anfoterica, che gli consente di reagire con acidi e basi. Questa proprietà è caratteristica di Cr3+.
Quando reagisci con gli acidi, Cr (OH2)3(OH)3 si dissolve perché i ponti idrossilici si disgregano, responsabile dell'aspetto gelatinoso del precipitato.
D'altra parte, quando viene aggiunta più base, l'OH- continuano a sostituire le molecole d'acqua, formando il complesso negativo [Cr (OH2)2(OH)4]-. Questo complesso rende la soluzione di un colore verde chiaro, che si intensifica con il procedere della reazione.
Quando tutti i Cr (OH2)3(OH)3 Una volta che ha reagito, si ottiene un complesso finale come indicato dall'equazione chimica:
Cr (OH2)3(OH)3 + 3 OH- <=> [Cr (OH)6] 3- + 3 H2O
Questo complesso negativo è associato ai cationi circostanti (Na+se la base è NaOH) e dopo l'evaporazione dell'acqua precipita il sale di cromite di sodio (NaCrO2, verde smeraldo). Pertanto, sia il mezzo acido che quello basico sono in grado di sciogliere l'idrossido di cromo.
Sintesi di idrossido di cromo in campo industriale
Nell'industria è prodotto dalla precipitazione del solfato di cromo con soluzioni di idrossido di sodio o idrossido di ammonio. Allo stesso modo, l'idrossido di cromo è prodotto dalla reazione schematizzata:
CrO72- + 3 SO2 + 2H+ => 2 Cr3+ + 3 SO42- + H2O
Cr3+ + 3OH- => Cr (OH)3
Come mostrato nella procedura precedente, la riduzione del cromo VI al cromo III ha una grande importanza ecologica.
Il cromo III è relativamente innocuo per il biota, mentre il cromo VI è tossico e cancerogeno, oltre che molto solubile, quindi è importante eliminarlo dall'ambiente.
La tecnologia di trattamento delle acque reflue e del suolo include una riduzione di Cr (VI) a Cr (III).
applicazioni
- Formulazione di trucchi.
- Coloranti per capelli.
- Vernici per unghie.
- Prodotti per la cura della pelle.
- Prodotti per la pulizia.
- Nella finitura dei metalli, che rappresenta il 73% del suo consumo nel settore.
- Nella conservazione del legno.
riferimenti
- Whitten, Davis, Peck & Stanley. Chimica. (8 ° ed.). CENGAGE Learning, p 873, 874.
- PubChem. (2018). Idrossido cromico Estratto il 18 aprile 2018 da: pubchem.ncbi.nlm.nih.gov
- N4TR! UMbr. (22 giugno 2015). Idrossido di cromo (III). [Figura]. Estratto il 18 aprile 2018 da: commons.wikimedia.org
- Martínez Troya, D., Martín-Pérez, J.J. Studio per l'uso sperimentale di ossidi di cromo e idrossidi nelle classi medie. BORAX nº 2 (1) -Recensione di Chimica Pratica per Secondario e Bachillerato-IES. Zaframagón-ISSN 2529-9581.
- Sintesi, caratterizzazione e stabilità degli idrossidi Cr (III) e Fe (III). (2014) Papassiopi, N., Vaxevanidou, K., Christou, C., Karagianni, E. e Antipas, G. J. Hazard Mater. 264: 490-497.
- PrebChem. (9 febbraio 2016). Preparazione di idrossido di cromo (III). Estratto il 18 aprile 2018 da: prepchem.com
- Wikipedia. (2018). Idrossido di cromo (III). Estratto il 18 aprile 2018 da: en.wikipedia.org




