Formula, proprietà, rischi e usi dell'ossido di plumb (PbO)
il ossido grassoccio, noto anche come ossido di piombo (II) o monossido di piombo, è un composto chimico di formula PbO. Si trova in due polimorfi: il litargirio e il masicotite. La sua struttura è illustrata nella figura 1.
Ritornando alla composizione, il litargirio è il prodotto ossidato del piombo fuso che è stato agitato o nebulizzato per incorporare aria, quindi raffreddato e macinato per formare la polvere gialla.
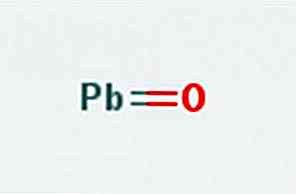
Il nome masicotite è usato sia per il minerale nativo che per il prodotto di monossido di piombo prodotto riscaldando il carbonato di piombo a 300ºC (monossido di piombo, 2016). Questi minerali sono mostrati in figura 2.

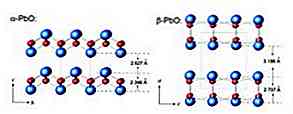
La masicotite ha una struttura ortorombica mentre il litargamento ha una struttura cristallina tetragonale. L'ossido di piombo (II) ha la capacità di cambiare struttura quando riscaldato o raffreddato. Queste strutture sono mostrate in Figura 3.
Il PbO è prodotto dall'ossidazione del piombo metallico. Il metallo viene fuso per produrre compresse di piombo, quindi macinato tra 170 ~ 210 ° C e passato attraverso la fiamma per l'ossidazione a temperature superiori a 600 ° C. I prodotti di ossido vengono schiacciati per ottenere l'ossido di piombo finito (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
Il PbO è prodotto su larga scala come prodotto intermedio nella raffinazione di minerali di piombo in piombo metallico. Il minerale principale utilizzato è la galena (solfuro di piombo (II)). Ad alta temperatura (1000 ° C) lo zolfo viene convertito nell'ossido nel seguente modo:
2PbS + 3O2 → 2PbO + 2SO2
indice
- 1 Proprietà fisiche e chimiche dell'ossido di plumbo
- 2 Reattività e rischi
- 3 usi
- 4 riferimenti
Proprietà fisiche e chimiche dell'ossido plumboide
Il monossido di piombo può presentare due aspetti diversi: come polvere secca gialla con struttura ortorombica (masicotite) o come cristalli tetragonali rossastri (litargirio). Entrambe le forme sono illustrate nella figura 4.

Il composto ha un peso molecolare di 223,20 g / mol e una densità di 9,53 g / ml. Ha un punto di fusione di 888 ° C e un punto di ebollizione di 1470 ° C (National Center for Biotechnology Information, S.F.).
Il composto non è molto solubile in acqua, essendo in grado di sciogliere solo 0,0504 grammi per litro a 25 ° C sotto forma di masicotite e 0,1065 grammi per litro a 25 ° C sotto forma di carica. Il composto è anche insolubile in alcool. È solubile in acido acetico, HNO3 e alcali diluiti (Royal Society of Chemistry, 2015).
Il composto è un debole agente ossidante o riducente, tuttavia, possono ancora verificarsi reazioni di ossido-riduzione. Questi composti non sono reattivi all'acqua.
L'ossido di piombo ossida il carburo di alluminio con l'incandescenza quando riscaldato. Miscele di ossido di piombo con polvere di alluminio (come con altri metalli: sodio, zirconio) provocano un'esplosione violenta.
Reattività e rischi
Il monossido di piombo è un composto classificato come velenoso. La sostanza è tossica per il sistema nervoso centrale e può essere cancerogena nell'uomo (Scheda di dati di sicurezza, ossido di piombo, giallo, 2013).
I sintomi dell'avvelenamento precoce sono linee di piombo che appaiono sul bordo delle gengive e la pelle diventa grigiastro. La sindrome neurastenica si presenterà anche nel periodo iniziale di avvelenamento.
L'avvelenamento cerebellare può causare depressione da avvelenamento da piombo, mania da avvelenamento da piombo, nonché tossicità da piombo e sensibilità a paralisi multipla di neuriti.
L'avvelenamento da piombo può anche causare anemia ipocromica e disordini metabolici ed endocrini. Inoltre, l'avvelenamento da piombo può inibire l'attività di alcuni enzimi nel sistema digestivo e causare indigestione, gravi dolori addominali e danni al fegato. Può anche causare ipertensione e aumento del colesterolo.
Se c'è un forte dolore addominale, possono essere prese alcune misure come iniezione sottocutanea di atropina e altri farmaci, addominali caldi, clistere, bagno di acqua calda e così via. La concentrazione massima consentita nell'aria è 0,01 mg / m3 (monossido di piombo, 2016).
In caso di contatto con gli occhi o la pelle, lavare abbondantemente con acqua. In caso di inalazione o ingestione, la vittima deve essere portata in un luogo arieggiato. Il vomito non dovrebbe essere indotto. Se la vittima non respira, deve essere somministrata la rianimazione bocca-a-bocca.
In tutti i casi è necessario consultare immediatamente un medico. Il monossido di piombo è un composto nocivo per l'ambiente, il bioaccumulo di questa sostanza chimica può verificarsi nelle piante e nei mammiferi.
Si raccomanda vivamente che questa sostanza non entri nell'ambiente, quindi deve essere maneggiata e conservata secondo le disposizioni stabilite (Istituto nazionale per la sicurezza e la salute sul lavoro, 2015).
applicazioni
Il monossido di piombo è stato usato come essiccatore di vernici e come flusso basso fuoco nella produzione di ceramica e vetro.Il cristallo al piombo viene utilizzato nella produzione di vasellame di alta qualità.
Usando il monossido di piombo come flusso, è possibile ottenere un vetro con un indice di rifrazione elevato e, di conseguenza, il gloss desiderato (Encyclopedia Britannica, 2016).
I conduttori ceramici a metà metallico hanno le conduttanze più elevate di tutte le ceramiche, eccetto quelle superconduttrici. L'ossido di piombo è un esempio di questo tipo di ceramica semi-metallica. Questi materiali hanno bande di energia di elettroni sovrapposte e sono quindi conduttori elettronici eccellenti (Mason, 2008).
L'ossido di piombo è utilizzato principalmente in tubi elettronici, tubi per imaging, vetro ottico, vetro al piombo anti-raggi X e gomme resistenti alle radiazioni.
È usato come reagente analitico, il flusso di silicato, ma anche per la precipitazione degli amminoacidi
L'ossido di piombo è utilizzato nella produzione di stabilizzanti in PVC di plastica ed è anche la materia prima di altri sali di piombo. Viene anche usato nella raffinazione dell'olio e per la determinazione dell'oro e dell'argento.
È anche usato come pigmento giallo nelle pitture e negli smalti. La masicotite era usata come pigmento dagli artisti tra il XV e il XVIII secolo.
Strati sottili di monossido di piombo vengono utilizzati per produrre colori iridescenti in ottone e bronzo. Il litargirio si miscela con il glicerolo per produrre cemento dall'idraulico.
riferimenti
- Enciclopedia Britannica. (10 ottobre 2016). Glass. Recupero dalla britannica: britannica.com.
- Kirk-Othmer. (1995). Enciclopedia della tecnologia chimica. 4 ° ed. Volumi 1. New York: John Wiley and Sons.
- Monossido di piombo (2016, 1 maggio). Estratto da cameo.mfa: cameo.mfa.org.
- Monossido di piombo (2016). Recupero da chemicalbook: chemicalbook.com.
- Mason, T. O. (2008, 12 marzo). Ceramica conduttiva. Recupero dalla britannica: britannica.com.
- Scheda di sicurezza del materiale Ossido di piombo, giallo. (2013, 21 maggio). Estratto da sciencelab: sciencelab.com.
- Centro nazionale per le informazioni sulle biotecnologie. (S.F.). Database composto di PubChem; CID = 14827. Estratto da PubChem: pubchem.ncbi.nlm.nih.gov.
- Istituto nazionale per la sicurezza e la salute sul lavoro. (2015, 22 luglio). LEAD (II) OSSIDO. Estratto da cdc.gov: cdc.gov.
- Royal Society of Chemistry. (2015). Ossido di piombo (II). Estratto da chemspider: chemspider.com.


