Teoria delle bande Modello ed esempi
il teoria della banda è quello che definisce la struttura elettronica del solido nel suo insieme. Può essere applicato a qualsiasi tipo di solido, ma è nei metalli in cui si riflettono i suoi più grandi successi. Secondo questa teoria, il legame metallico risulta dall'attrazione elettrostatica tra gli ioni caricati positivamente e gli elettroni mobili nel cristallo.
Pertanto, il cristallo metallico ha un "mare di elettroni", che può spiegare le sue proprietà fisiche. L'immagine inferiore illustra il collegamento metallico. I punti viola degli elettroni sono delocalizzati in un mare che circonda gli atomi di metallo caricati positivamente.

Il "mare di elettroni" è formato dai contributi individuali di ciascun atomo di metallo. Questi contributi sono i suoi orbitali atomici. Le strutture metalliche sono generalmente compatte; più sono compatte, maggiori sono le interazioni tra i loro atomi.
Di conseguenza, i loro orbitali atomici si sovrappongono per generare orbitali molecolari molto stretti in energia. Il mare degli elettroni è quindi solo un grande insieme di orbitali molecolari con diversi intervalli di energie. La gamma di queste energie forma quelle che sono conosciute come bande di energia.
Queste bande sono presenti in qualsiasi regione del cristallo, motivo per cui è considerato come un tutto, e quindi la definizione di questa teoria.
indice
- 1 modello di bande di energia
- 1.1 Livello di Fermi
- 2 semiconduttori
- 2.1 Semiconduttori intrinseci ed estrinseci
- 3 Esempi di teoria delle bande applicate
- 4 riferimenti
Modello di bande energetiche

Quando l'orbitale di un atomo di metallo interagisce con quello del suo vicino (N = 2), si formano due orbitali molecolari: un legame (banda verde) e un anti-link (banda rosso scuro).
Se N = 3, ora sono formati tre orbitali molecolari, di cui quello centrale (banda nera) non è vincolante. Se N = 4, si formano quattro orbitali e quello con il carattere di legame più grande e quello con il più grande carattere anti-congelamento sono ulteriormente separati.
La gamma di energia disponibile per gli orbitali molecolari si sta espandendo quando gli atomi di metallo del cristallo forniscono i loro orbitali. Ciò si traduce anche in una diminuzione dello spazio energetico tra gli orbitali, al punto che si condensano in una banda.
Questa banda composta da orbitali ha regioni a bassa energia (quelle dei colori verde e giallo) e ad alta energia (quelle dei colori arancione e rosso). Le loro estremità energetiche hanno una bassa densità; tuttavia, la maggior parte degli orbitali molecolari (strisce bianche) sono concentrati al centro.
Ciò significa che gli elettroni "corrono più veloci" attraverso il centro della banda che alle loro estremità.
Livello di Fermi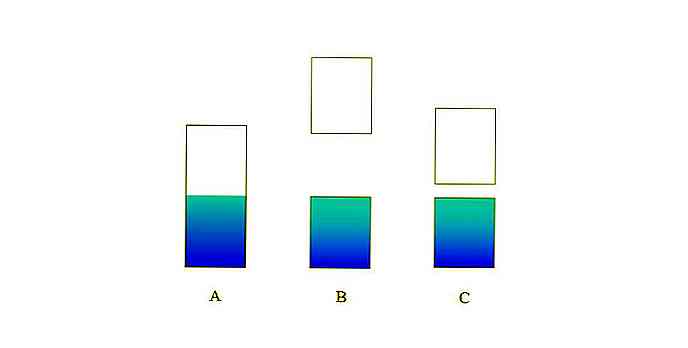
È lo stato di energia più alto occupato dagli elettroni in un solido alla temperatura zero assoluta (T = 0 K).
Una volta costruita la s-band, gli elettroni iniziano ad occupare tutti i loro orbitali molecolari. Se il metallo ha un singolo elettrone di valenza (s)1), tutti gli elettroni nel suo cristallo occuperanno metà della banda.
L'altra metà non occupata è conosciuta come la band di guida, mentre la banda piena di elettroni è chiamata la banda di valenza.
Nell'immagine superiore A rappresenta una tipica banda di valenza (blu) e una banda di conduzione (bianca) per un metallo. La linea bluastra indica il livello di Fermi.
Poiché i metalli hanno anche p-orbitali, si combinano allo stesso modo per originare una p-band (bianca).
Nel caso dei metalli, le bande s e p sono molto vicine all'energia. Ciò consente le loro sovrapposizioni, promuovendo gli elettroni dalla banda di valenza alla banda di conduzione. Quanto sopra accade anche a temperature poco superiori a 0 K.
Per i metalli di transizione e dal periodo 4 verso il basso, è anche possibile la formazione di bande d.
Il livello di Fermi rispetto alla banda di conduzione è molto importante per determinare le proprietà elettriche.
Ad esempio, una Z di metallo con un livello di Fermi molto vicino alla banda di conduzione (la banda vuota più vicina in energia) ha una conduttività elettrica più elevata di una X di metallo in cui il suo livello di Fermi è lontano da quella banda.
Semiconduttori
La conduttività elettrica consiste quindi nella migrazione di elettroni da una banda di valenza ad una banda di conduzione.
Se il divario di energia tra le due bande è molto grande, si ha un solido isolante (come con B). D'altra parte, se questo spazio è relativamente piccolo, il solido è un semiconduttore (nel caso di C).
Di fronte a un aumento della temperatura, gli elettroni della banda di valenza acquisiscono energia sufficiente per migrare verso la banda di conduzione. Ciò si traduce in una corrente elettrica.
In effetti, questa è una qualità di materiali solidi o semiconduttori: a temperatura ambiente sono isolanti, ma a temperature elevate sono conduttori.
Semiconduttori intrinseci ed estrinseci

I conduttori intrinseci sono quelli in cui il divario di energia tra la banda di valenza e la banda di conduzione è sufficientemente piccolo in modo che l'energia termica consenta il passaggio di elettroni.
D'altra parte, i conduttori estrinseci mostrano cambiamenti nelle loro strutture elettroniche dopo il drogaggio con impurità, che aumentano la loro conduttività elettrica. Questa impurità può essere un altro metallo o un elemento non metallico.
Se l'impurità ha più elettroni di valenza, può fornire una banda di donatori che funge da ponte per gli elettroni della banda di valenza da attraversare nella banda di conduzione. Questi solidi sono semiconduttori di tipo n. Qui la denominazione n deriva da "negativo".
Nell'immagine in alto la banda del donatore è illustrata nel blocco blu appena sotto la banda di guida (Tipo n).
D'altra parte, se l'impurità ha meno elettroni di valenza, fornisce una banda accettore, che accorcia il divario energetico tra la banda di valenza e la banda di conduzione.
Gli elettroni migrano prima verso questa banda, lasciandosi dietro "buchi positivi", che si muovono nella direzione opposta.
Poiché questi gap positivi segnano il passaggio di elettroni, il solido o materiale è un semiconduttore di tipo p.
Esempi di teoria delle bande applicate
- Spiega perché i metalli sono brillanti: i loro elettroni mobili possono assorbire radiazioni su un'ampia gamma di lunghezze d'onda quando salgono a livelli di energia più elevati. Poi emettono luce, tornando ai livelli più bassi della band.
- Il silicio cristallino è il materiale semiconduttore più importante. Se una porzione di silicio è drogata con tracce di un elemento del gruppo 13 (B, Al, Ga, In, Tl), diventa un semiconduttore di tipo p. Mentre se è drogato con un elemento del gruppo 15 (N, P, As, Sb, Bi) diventa un semiconduttore di tipo n.
- I diodi a emissione luminosa (LED) sono un semiconduttore del giunto p-n. Cosa intendi? Che il materiale abbia entrambi i tipi di semiconduttori, sia il n che il p. Gli elettroni migrano dalla banda di conduzione del semiconduttore di tipo n alla banda di valenza del semiconduttore di tipo p.
riferimenti
- Whitten, Davis, Peck & Stanley. Chimica. (8 ° ed.). Apprendimento CENGAGE, p 486-490.
- Shiver e Atkins. (2008). Chimica inorganica (Quarta edizione., Pp. 103-107, 633-635). Mc Graw Hill.
- Ship C. R. (2016). Band Theory of Solids. Estratto il 28 aprile 2018 da: hyperphysics.phy-astr.gsu.edu
- Steve Kornic. (2011). Passando da obbligazioni a gruppi dal punto di vista del farmacista. Estratto il 28 aprile 2018 da: chembio.uoguelph.ca
- Wikipedia. (2018). Semiconduttore estrinseco Estratto il 28 aprile 2018 da: en.wikipedia.org
- Byju'S. (2018). Teoria delle bande dei metalli. Estratto il 28 aprile 2018 da: byjus.com



