Struttura chimica, usi, proprietà di ossido di alluminio (Al2O3)
il ossido di alluminio (Al2O3 di formula chimica), chiamato anche allumina, ossido di alluminio, corindone o triossido di alluminio, è un ossido di metallo che viene prodotto dalla reazione tra un metallo e ossigeno (O). È anche noto come ossido basico, per la facilità di formare idrossidi quando reagiscono con l'acqua.
Questo perché l'alluminio che si trova nella famiglia IIIA della tavola periodica ha la tendenza a produrre gli elettroni dell'ultimo livello di energia. Questa tendenza è dovuta alla sua natura metallica e alla sua bassa elettronegatività (1,61 sulla scala di Pauling), che le conferisce proprietà elettropositive e la converte in un catione.

Al contrario, l'ossigeno è un non-metallo ed è più elettronegativo a causa della sua elevata elettronegatività (3.44 sulla scala di Pauling). Pertanto, tende a stabilizzare l'energia elettronica del suo ultimo livello accettando gli elettroni, il che la rende un anione.
I legami formati sono legami forti, che conferiscono all'ossido di alluminio una grande forza. In natura, l'alluminio non si trova in forma nativa come oro, argento, rame, zolfo e carbonio (diamante).
Ciò significa che l'alluminio non è combinato con nessun altro elemento; Questo metallo è mescolato con ossigeno, formando composti come corindone o smeriglio, che sono composti altamente resistenti e abrasivi.
indice
- 1 formula e struttura chimica
- 2 proprietà fisiche
- 3 proprietà chimiche
- 4 usi
- 5 riferimenti
Formula e struttura chimica
Formula molecolare: Al2O3
Formula strutturale: 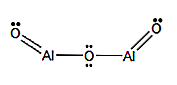
Proprietà fisiche
- È disponibile in commercio come polvere bianca, inodore e non tossico.
- Come composto minerale corrisponde al gruppo di ematite. È un materiale molto duro che ha un'elevata resistenza all'usura, quindi è usato come materiale abrasivo.
- Conduce facilmente l'elettricità ed è anche un buon conduttore termico.
- È resistente alle reazioni con acidi e basi ad alte temperature.
- Può apparire in diversi colori: rosso o rubino (dove gli ioni di alluminio sono stati sostituiti da Cr3+), giallo, rosa, blu zaffiro, viola, verde, grigio e persino incolore.
- La sua luminosità è vitrea o adamantine (diamante)
- Ha una striscia bianca molto delicata a causa della sua durezza.
- La sua durezza nella scala di Mohs è 9. Ciò significa che può graffiare altri minerali di minore durezza di esso; tuttavia, non può graffiare il diamante che ha una durezza di 10 sulla stessa scala.
- La sua densità è di 3,96 g / cm3
- Il suo peso molecolare (massa molare) è 101,96 g / mol.
- Il suo punto di fusione è 2040 ° C.
- Il suo punto di ebollizione è 2977 ° C.
- È insolubile in acqua.
Proprietà chimiche
L'ossido di alluminio non reagisce con l'acqua a meno che non sia in presenza di una base forte.
Tuttavia, quando reagisce con gli acidi si comporta come se fosse una base:

Mostra anche proprietà acide quando reagito con basi:

Sebbene l'acqua non si formi in questa reazione, è considerata acido-base perché Al2O3 neutralizza NaOH. Pertanto, l'Al2O3 È classificato come un ossido anfotero perché ha proprietà sia acide che basiche.
Nella formazione di alcheni e cicloalceni, una delle forme più utilizzate nell'industria e in laboratorio è la disidratazione degli alcoli.
Per questo, il vapore di alcol viene fatto circolare su un catalizzatore caldo di allumina o ossido di alluminio (Al2O3); in questo caso è considerato un acido di Lewis.

applicazioni
- L'allumina è utilizzata nel settore per ottenere alluminio.
- È usato come materiale ceramico grazie alla sua elevata resistenza alla corrosione ad alte temperature e all'usura.
- Viene utilizzato come isolamento termico, specialmente nelle celle elettrolitiche.
- Ha la capacità di assorbire l'acqua, che lo rende adatto all'uso come agente essiccante.
- È usato come agente catalitico nelle reazioni chimiche
- Grazie alla sua elevata stabilità termica, viene utilizzato come ossidante nelle reazioni chimiche che vengono effettuate a temperature elevate.
- Impedisce l'ossidazione del catodo e dei terminali anodici in una cella elettrolitica.
- A causa della sua grande durezza e resistenza, è utilizzato in odontoiatria per la preparazione di pezzi dentali.
- È un buon isolante elettrico nelle candele dei veicoli che funzionano a benzina.
- È ampiamente utilizzato nei mulini a palle per la preparazione di ceramiche e smalti.
- Grazie alla sua leggerezza, nei processi ingegneristici viene utilizzato per costruire aeroplani.
- A causa del suo alto punto di ebollizione, viene utilizzato per realizzare utensili da cucina come padelle e padelle refrattarie.
- Viene utilizzato nella strumentazione di macchine per prove termiche.
- Nell'industria elettronica, è utilizzato nella fabbricazione di componenti passivi per l'interconnessione elettrica e nella produzione di resistori e condensatori.
- Utilizzato nella produzione di riempitivi per la saldatura.
- L'ossido di alluminio è usato per il rivestimento dell'ossido di titanio (pigmento usato per vernici e carte di plastica).Ciò impedisce reazioni tra l'ambiente e questo tipo di pigmenti, che non si decompone o non arrugginisce.
- È usato come abrasivo nei dentifrici.
- È usato in emodialisi.
- Come additivo nell'industria alimentare, poiché è usato come agente di dispersione.
- È un agente antitraspirante di deodoranti.
- L'ossido di alluminio è stato utilizzato come materiale ortopedico. Poiché è un materiale inerte e poroso, lo rende adatto per l'uso in questo tipo di impianti. Questi impianti consentono la crescita fibrovascolare, motivo per cui i fibroblasti e gli osteoblasti proliferano rapidamente in questo materiale.
- L'impianto bioceramico è realizzato con allumina. È leggero e ha una struttura dei pori uniforme molto ben collegata tra loro. La struttura microcristallina è più liscia rispetto alla superficie ruvida. Presenta una minore infiammabilità dopo un periodo postoperatorio rispetto ad altri materiali utilizzati per gli impianti.
- Le scaglie di ossido di alluminio producono effetti riflettenti all'interno delle vernici utilizzate per le automobili.
- In alcune raffinerie, l'ossido di alluminio viene utilizzato per convertire i gas tossici dell'idrogeno solforato in zolfo elementare.
- La forma di allumina chiamata allumina attivata ha grandi benefici nel trattamento delle acque reflue come le falde acquifere grazie alla sua capacità di adsorbire molti inquinanti nocivi per l'ambiente, nonché di filtrare il materiale di scarto che viene dissolto in acqua e che è più grande del poro dei fogli di allumina.
riferimenti
- Chang, R; chimica, 1992 (quarta edizione), Messico. McGraw-Hill Interamericana del Messico.
- Pine.S; Hendrickson, J; Cram, D; Hammond, G (1980), Chimica organica, (quarta edizione), Messico, McGraw-Hill de México
- Kinjanjui, L., (s.f) Proprietà e usi dell'ossido di alluminio,Funziona ancora, Recuperato, itstillworks.com
- Panjian L., Chikara, O., Tadashi, K., Kazuki, N., Naohiro, S. "e" Klaas de G., (1994). Il ruolo della silice idrata, della titania e dell'allumina nell'indurre l'apatite sugli impianti. Journal of Biomedicals research. Volume 18, pp. 7-15. DOI: 10.1002 / jbm.820280103.
- Guida completa alle informazioni su rocce, minerali e pietre preziose., Mineral.net., Recuperato, minerals.net
- LaNore, S. (2017), Caratteristiche fisiche dell'ossido di alluminio, sciencing,Recuperato, sciencing.com



