Nomenclatura degli ossidi, tipi, proprietà ed esempi
il ossidi sono una famiglia di composti binari dove ci sono interazioni tra l'elemento e l'ossigeno. Quindi un ossido ha una formula molto generale del tipo EO, dove E è qualsiasi elemento.
A seconda di molti fattori, come la natura elettronica di E, il suo raggio ionico e le sue valenze, possono essere formati vari tipi di ossidi. Alcuni sono molto semplici e altri, come Pb3O4, (chiamato minium, arcazón o piombo rosso) sono mescolati; cioè, derivano dalla combinazione di più di un semplice ossido.

Ma la complessità degli ossidi può andare oltre. Ci sono miscele o strutture in cui più di un metallo può intervenire e dove inoltre le proporzioni non sono stechiometriche. Nel caso di Pb3O4, il rapporto Pb / O è uguale a 3/4, di cui sia il numeratore che il denominatore sono numeri interi.
Negli ossidi non stechiometrici le proporzioni sono numeri decimali. L'E0.75O1.78, è un esempio di un ipotetico ossido non stechiometrico. Questo fenomeno si verifica con i cosiddetti ossidi metallici, in particolare con i metalli di transizione (Fe, Au, Ti, Mn, Zn, ecc.).
Tuttavia, ci sono ossidi le cui caratteristiche sono molto più semplici e differenziabili, così come il carattere ionico o covalente. In quegli ossidi dove predomina il carattere ionico, essi saranno composti da cationi E+ e anioni O2-; e quei legami puramente covalenti, semplici (E-O) o doppi (E = O).
Ciò che determina il carattere ionico di un ossido è la differenza di elettronegatività tra E e O. Quando E è un metallo molto elettropositivo, allora EO avrà un alto carattere ionico. Mentre se E è elettronegativo, cioè un non-metallo, il suo ossido EO sarà covalente.
Questa proprietà definisce molti altri esibiti dagli ossidi, come è la loro capacità di formare basi o acidi in soluzione acquosa. Da qui sorgono i cosiddetti ossidi basici e acidi. Coloro che non si comportano come uno dei due, o che al contrario manifestano entrambe le caratteristiche, sono ossidi neutri o anfoteri.
indice
- 1 Nomenclatura
- 1.1 Nomenclatura sistematica
- 1.2 Nomenclatura dello stock
- 1.3 Nomenclatura tradizionale
- 2 tipi di ossidi
- 2.1 Ossidi di base
- 2.2 Ossidi acidi
- 2.3 Ossidi neutri
- 2.4 Ossidi anfoteri
- 2.5 Ossidi misti
- 3 proprietà
- 4 Come si formano?
- 5 Esempi di ossidi
- 5.1 Ossidi metallici di transizione
- 5.2 Esempi aggiuntivi
- 6 riferimenti
nomenclatura
Esistono tre modi per menzionare gli ossidi (che si applicano anche a molti altri composti). Questi sono corretti indipendentemente dal carattere ionico dell'ossido di ossido di etilene, quindi i loro nomi non dicono nulla sulle loro proprietà o strutture.
Nomenclatura sistematica
Dati gli ossidi EO, E2O, E2O3 e EO2A prima vista, ciò che è dietro le loro formule chimiche non può essere conosciuto. Tuttavia, i numeri indicano le proporzioni stechiometriche o il rapporto E / O. Da questi numeri possono essere dati nomi anche se non è specificato con quale valenza "funziona" E.
I numeri di atomi sia per E che per O sono indicati dai prefissi dei numeri greci. In questo modo, mono- significa che c'è solo un atomo; di-, due atomi; tri-, tre atomi e così via.
Quindi, i nomi degli ossidi precedenti secondo la nomenclatura sistematica sono:
-si chignonE (EO) ossido.
-si chignonossido diE (E2O).
-Triossido di diE (E2O3).
-diE ossido (EO2).
Applicando quindi questa nomenclatura per il Pb3O4, l'ossido rosso della prima immagine, abbiamo:
Pb3O4: tetraossido di triportare.
Per molti ossidi misti, o con alti rapporti stechiometrici, è molto utile ricorrere alla nomenclatura sistematica per nominarli.
Nomenclatura di borsa
Valencia
Sebbene non sia noto quale elemento sia E, è sufficiente che il rapporto E / O conosca quale valenza sta usando nel suo ossido. Come? Attraverso il principio di elettroneutrality. Ciò richiede che la somma delle cariche degli ioni in un composto sia uguale a zero.
Ciò avviene assumendo un carattere ionico alto per ogni ossido. Quindi, l'O ha carica -2 perché è O2-e E deve fornire n + in modo da neutralizzare le cariche negative dell'anione di ossido.
Ad esempio, nell'EO l'atomo E funziona con valenza +2. Perché? Perché altrimenti non poteva neutralizzare il carico -2 dell'unica O. Per la E2Oppure, la E ha valenza +1, poiché la carica +2 deve essere divisa tra i due atomi di E.
E nella E2O3, devono essere calcolate prima le spese negative apportate dalla O. Come tre di esse, quindi: 3 (-2) = -6.Per neutralizzare il carico -6 è necessario che E fornisca +6, ma poiché ce ne sono due, +6 è diviso per due, lasciando E con una valenza di +3.
Regola mnemonica
O ha sempre valenza -2 negli ossidi (a meno che non sia un perossido o un superossido). Quindi una regola mnemonica per determinare la valenza di E è semplicemente prendere in considerazione il numero che accompagna l'O. E, da parte sua, avrà il numero 2 che lo accompagna, e se no, significa che c'è stata una semplificazione.
Ad esempio, in EO la valenza di E è +1, perché anche se non è scritta, c'è solo un O. E per l'EO2, poiché non c'è nessuna E accompagnante, c'è stata una semplificazione, e per farla apparire deve essere moltiplicata per 2. Quindi, la formula rimane come E2O4 e la valenza di E è quindi +4.
Tuttavia, questa regola non riesce per alcuni ossidi, come Pb3O4. Pertanto, è sempre necessario eseguire i calcoli di neutralità.
In cosa consiste?
Avendo la valenza di E a portata di mano, la nomenclatura di borsa consiste nello specificarlo tra parentesi e con numeri romani. Di tutte le nomenclature questo è il più semplice e preciso rispetto alle proprietà elettroniche degli ossidi.
Se E, d'altra parte, ha solo una valenza (che può essere trovata nella tabella periodica), allora non è specificata.
Quindi, per l'ossido EO se E ha valenza +2 e +3, è chiamato: ossido di (nome di E) (II). Ma se E ha solo valenza +2, allora il suo ossido è chiamato: ossido (nome di E).
Nomenclatura tradizionale
Per citare il nome degli ossidi, i suffissi -ico o -oso, per le valenze più grandi o più piccoli, dovrebbero essere aggiunti ai loro nomi latini. Nel caso ce ne siano più di due, vengono utilizzati i prefissi -hype, per il più piccolo e -per, per il più grande di tutti -serie.
Ad esempio, piombo funziona con valenze +2 e +4. Nel PbO ha valenza +2, quindi è chiamato: ossido plumbous. Mentre il PbO2 Si chiama: ossido plumico.
E il Pb3O4come si chiama secondo le due nomenclature precedenti? Non ha nome Perché? Perché il Pb3O4 in realtà consiste in una miscela 2 [PbO] [PbO2]; cioè, il solido rosso ha una doppia concentrazione di PbO.
Per questo motivo sarebbe sbagliato cercare di dare un nome al Pb3O4 ciò non consiste nella nomenclatura sistematica o nel gergo popolare.
Tipi di ossidi
A seconda di quale parte della tavola periodica è E e, quindi, della sua natura elettronica, si può formare un tipo di ossido o un altro. Da qui derivano più criteri per assegnare loro un tipo, ma i più importanti sono quelli relativi alla loro acidità o basicità.
Ossidi di base
Gli ossidi di base sono caratterizzati dall'essere ionici, metallici e più importanti, generando una soluzione basica quando dissolti in acqua. Per determinare sperimentalmente se un ossido è basico, deve essere aggiunto a un contenitore con acqua e indicatore universale disciolto in esso. La sua colorazione prima di aggiungere l'ossido deve essere verde, pH neutro.
Una volta che l'ossido viene aggiunto all'acqua, se il suo colore cambia da verde a blu, significa che il pH è diventato fondamentale. Questo perché stabilisce un equilibrio di solubilità tra l'idrossido formato e l'acqua:
EO (s) + H2O (l) => E (OH)2(s) <=> E2+(ac) + OH-(Aq)
Sebbene l'ossido sia insolubile in acqua, è sufficiente che una piccola parte si dissolva per modificare il pH. Alcuni ossidi basici sono così solubili da generare idrossidi caustici come NaOH e KOH. Cioè, gli ossidi di sodio e di potassio, Na2O e K2Oppure, sono molto semplici. Notare la valenza di +1 per entrambi i metalli.
Ossidi acidi
Gli ossidi acidi sono caratterizzati dall'avere un elemento non metallico, sono covalenti e generano anche soluzioni acide con acqua. Ancora una volta, la sua acidità può essere controllata con l'indicatore universale. Se questa volta aggiungendo l'ossido all'acqua, il suo colore verde diventa rossastro, quindi è un ossido acido.
Che reazione ha luogo? Il seguente:
EO2(s) + H2O (l) => H2EO3(Aq)
Un esempio di un ossido acido, che non è un solido, ma un gas, è CO2. Quando si scioglie in acqua, forma l'acido carbonico:
CO2(g) + H2O (l) <=> H2CO3(Aq)
Allo stesso modo, il CO2 Non è composto da anioni O2- e C cazioni4+, ma in una molecola formata da legami covalenti: O = C = O. Questa è forse una delle maggiori differenze tra ossidi di base e acidi.
Ossidi neutrali
Questi ossidi non cambiano il colore verde dell'acqua a pH neutro; cioè, non formano idrossidi, né acidi in soluzione acquosa. Alcuni di loro sono: N2O, NO e CO. Come il CO, hanno legami covalenti che possono essere illustrati dalle strutture di Lewis o da qualsiasi teoria dei link.
Ossidi anfoteri
Un altro modo per classificare gli ossidi dipende dal fatto che reagiscano con un acido o meno.L'acqua è un acido molto debole (e anche una base), quindi gli ossidi anfoteri non mostrano "entrambi i lati". Questi ossidi sono caratterizzati dalla reazione con acidi e basi.
L'ossido di alluminio, per esempio, è un ossido anfotero. Le seguenti due equazioni chimiche rappresentano la loro reazione con acidi o basi:
alla2O3(s) + 3H2SW4(ac) => Al2(SO4)3(ac) + 3H2O (l)
alla2O3(s) + 2NaOH (ac) + 3H2O (l) => 2NaAl (OH)4(Aq)
L'Al2(SO4)3 è il sale solfato di alluminio e NaAl (OH)4 un sale complesso chiamato sodio tetraidrossi alluminato.
Ossido di idrogeno, H2O (acqua), è anche anfotero, e questo è evidenziato nel suo equilibrio di ionizzazione:
H2O (l) <=> H3O+(ac) + OH-(Aq)
Ossidi misti
Gli ossidi misti sono quelli che consistono nella miscela di uno o più ossidi nello stesso solido. Il Pb3O4 È un esempio di loro. La magnetite, fede3O4, è anche un altro esempio di un ossido misto. La fede3O4 È una miscela di FeO e Fe2O3 in proporzioni 1: 1 (a differenza di Pb)3O4).
Le miscele possono essere più complesse, dando origine a una ricca varietà di minerali di ossido.
proprietà
Le proprietà degli ossidi dipendono dal loro tipo. Gli ossidi possono essere ionici (En +O2-), come CaO (Ca2+O2-), o covalente, come SO2, O = S = O.
Da questo fatto, e dalla tendenza degli elementi a reagire con acidi o basi, viene raccolto un numero di proprietà per ciascun ossido.
Inoltre, quanto sopra si riflette in proprietà fisiche come punti di fusione e di ebollizione. Gli ossidi ionici tendono a formare strutture cristalline molto resistenti al calore, quindi i loro punti di fusione sono alti (oltre i 1000 ° C), mentre il covalente fonde a basse temperature, o anche gas o liquidi.
Come si formano?
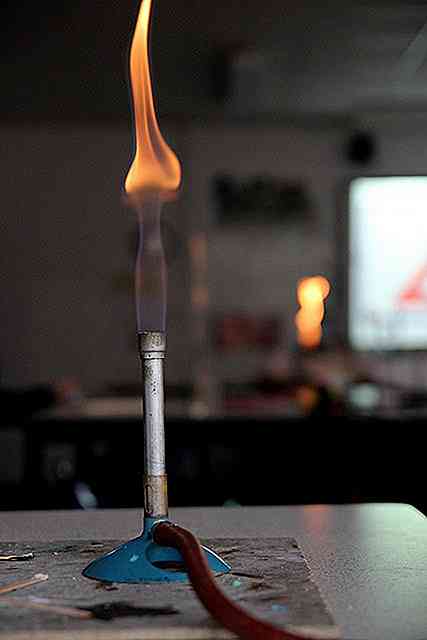
Gli ossidi si formano quando gli elementi reagiscono con l'ossigeno. Questa reazione può verificarsi con il semplice contatto con atmosfere ricche di ossigeno o richiede calore (come la fiamma di un accendino). Cioè, quando un oggetto viene bruciato, reagisce con l'ossigeno (purché sia presente nell'aria).
Se un pezzo di fosforo è preso, per esempio, e posto nella fiamma, brucerà e formerà l'ossido corrispondente:
4P (s) + 5O2(g) => P4O10(S)
Durante questo processo alcuni solidi, come il calcio, possono bruciare con una fiamma brillante e colorata.
Un altro esempio si ottiene bruciando legno o qualsiasi sostanza organica, che possiede carbonio:
C (s) + O2(g) => CO2(G)
Ma se c'è un'insufficienza di ossigeno si forma CO al posto di CO2:
C (s) + 1 / 2O2(g) => CO (g)
Nota come viene utilizzato il rapporto C / O per descrivere diversi ossidi.
Esempi di ossidi
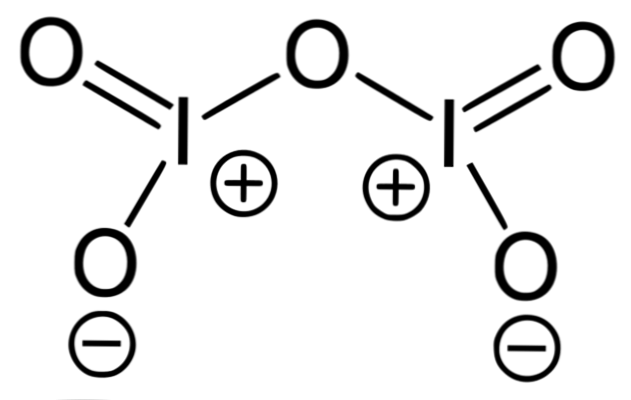
L'immagine superiore corrisponde alla struttura di ossido covalente I2O5, la forma più stabile di iodio. Nota i suoi legami semplici e doppi, così come le accuse formali di I e ossigeni ai suoi lati.
Gli ossidi di alogeno sono caratterizzati dall'essere covalenti e molto reattivi, come tali sono i casi di O2F2 (F-O-O-F) e OF2 (F-O-F). Diossido di cloro, ClO2per esempio, è l'unico ossido di cloro che viene sintetizzato su scala industriale.
Poiché gli alogeni formano ossidi covalenti, le loro valenze "ipotetiche" sono calcolate allo stesso modo attraverso il principio di elettroneutralità.
Ossidi metallici di transizione
Oltre agli ossidi di alogeno, abbiamo gli ossidi dei metalli di transizione:
-CoO: ossido di cobalto (II); ossido di cobalto; tu monossido di cobalto.
-HgO: ossido di mercurio (II); ossido mercurico; il monossido di mercurio.
-AG2O: ossido d'argento; ossido d'argento; o diplata monossido.
-au2O3: ossido d'oro (III); ossido aureico; o dioro triossido.
Altri esempi
-B2O3: ossido di boro; ossido borico; o diboro triossido.
-cl2O7: ossido di cloro (VII); ossido perclorico; dicloro epossido.
-NO: ossido di azoto (II); ossido nitrico; monossido di azoto.
riferimenti
- Shiver e Atkins. (2008). Chimica inorganica (quarta edizione). Mc Graw Hill.
- Ossidi di metallo e non metalliferi. Tratto da: chem.uiuc.edu
- Chimica gratuita online. (2018). Ossidi e ozono. Tratto da: freechemistryonline.com
- Toppr. (2018). Ossidi semplici. Tratto da: toppr.com
- Steven S. Zumdahl. (7 maggio 2018). Ossida. Enciclopedia Britannica. Tratto da: britannica.com
- Chimica LibreTexts. (24 aprile 2018). Ossidi. Tratto da: chem.libretexts.org
- Quimicas.net (2018). Esempi di ossidi. Recupero da: quimicas.net


